国立研究開発法人情報通信研究機構
国立大学法人大阪大学
国立大学法人大阪大学

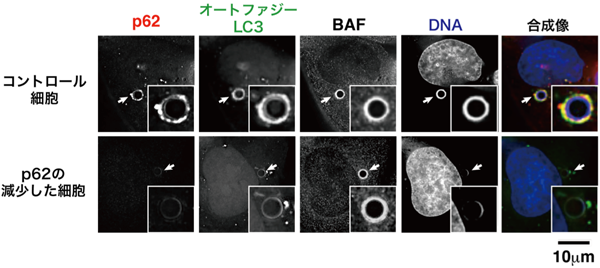
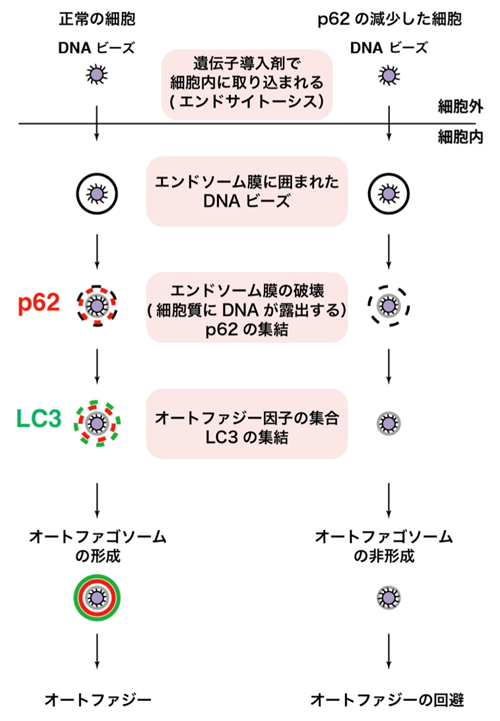
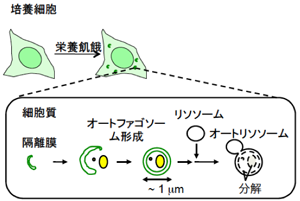
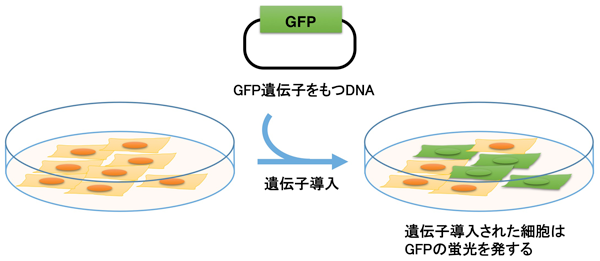
原口 徳子
Tel: 078-969-2241
E-mail: 


小川 英知
Tel: 06-6879-4621
E-mail: 



廣田 幸子
Tel: 042-327-6923
Fax: 042-327-7587
E-mail: 


中西 祥子
Tel: 06-6879-4692
E-mail: